
ページ右下のチャットよりお問い合わせください。
受付時間:9:00~17:30
(土・日・祝祭日及び当社休日を除く)
座談会
日時:2022年5月31日火曜日 18:30~20:00
開催形式:リモート形式
【司会】

工藤 正俊 先生
近畿大学医学部
消化器内科 主任教授
【出席者】

黒崎 雅之 先生
武蔵野赤十字病院
副院長・消化器科部長
【出席者】

小無田 美菜 先生
国際医療福祉大学成田病院
病理診断科 准教授
【出席者】

長谷川 潔 先生
東京大学 臓器病態外科学
人工臓器・移植外科 教授
(五十音順)
掲載されている薬剤の使用にあたっては添付文書をご参照ください。
肝内胆管癌の疫学
Q1:日本における肝内胆管癌の患者数は増えているか?
Q2:肝内胆管癌の予後は?
Q3:肝内胆管癌発生の危険因子は何か?
原発性肝癌における肝細胞癌と肝内胆管癌との鑑別診断
Q1:画像検査の非典型例には生検が推奨されるか?
Q2:肝内胆管癌の臨床病理学的特徴は?
Q3:病理検査による鑑別診断において重要なポイントは何か?
肝内胆管癌におけるがんゲノム診断
Q1:肝内胆管癌診療においてがん遺伝子パネル検査に基づくがんゲノム医療は有用か?
Q2:がん遺伝子パネル検査を想定した検体採取のタイミングは?
Q3:肝内胆管癌のがん遺伝子パネル検査における注意点は?
肝内胆管癌の薬物治療
Q1:肝内胆管癌に有効な二次治療は確立されているか?
Q2:切除不能肝内胆管癌におけるペミガチニブの適応と有効性は?
Q3:ペミガチニブ投与において注意が必要な副作用はあるか?
ディスカッションポイントのアンサー
Q1:日本における肝内胆管癌の患者数は増えているか?
⇒A1:肝内胆管癌の罹患数は年々増加している。
Q2:肝内胆管癌の予後は?
⇒A2:肝内胆管癌は患者の約半数がステージⅣで発見され、予後は極めて不良である。
Q3:肝内胆管癌発生の危険因子は何か?
⇒A3:肝内胆管癌には慢性肝疾患、胆管疾患、代謝系疾患など多数の危険因子がある。
肝内胆管癌の罹患率と予後
工藤 肝内胆管癌の罹患率は全世界的に増加傾向にあるとされています。はじめに、国内における肝内胆管癌の罹患率の推移や予後などの疫学についてお聞かせください。
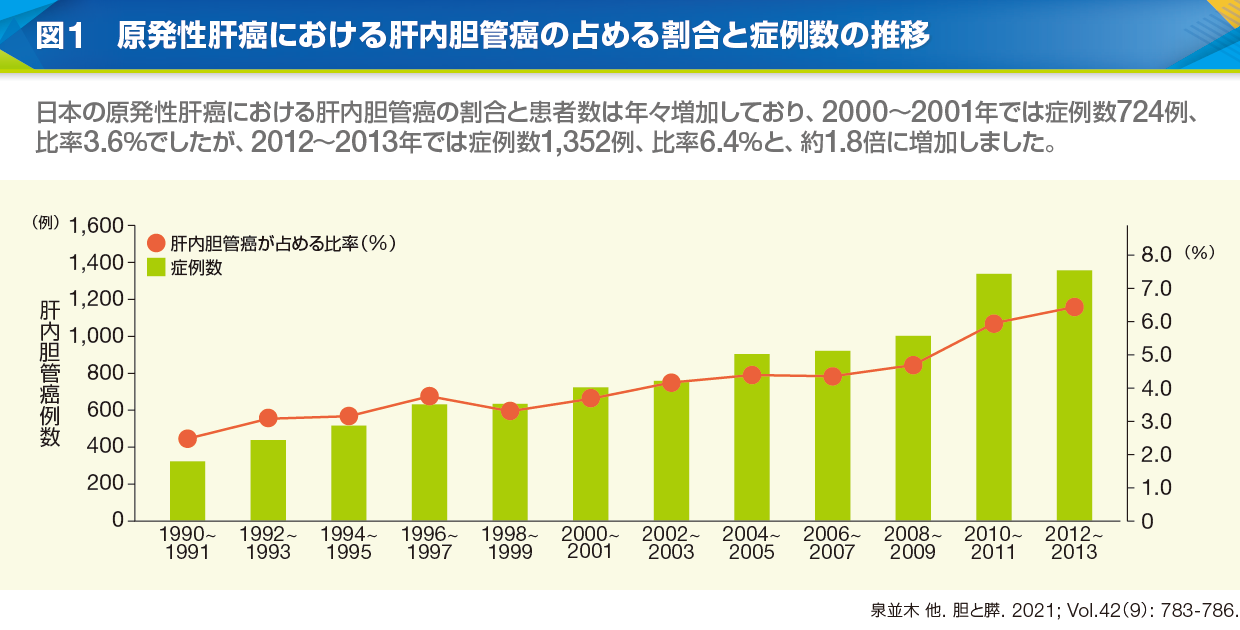
黒崎 日本肝癌研究会による追跡調査では、国内の原発性肝癌における肝内胆管癌の占める割合と症例数は年々増加しています(図1)。肝内胆管癌発生の母体となる慢性肝疾患の主体がウイルス性疾患から非ウイルス性疾患に変遷していることに加えて、画像診断や病理診断の精度が向上した影響も考えられますが、現在のところ右肩上がりに増加しています。
長谷川 胆道癌の予後についての海外の研究では、全生存期間(OS)中央値は遠位胆管癌22ヵ月、肝内胆管癌13.5ヵ月、肝門部領域胆管癌13.9ヵ月と報告されており1)、手術適応となる遠位胆管癌と比較して肝内胆管癌の予後は極めて不良です。肝内胆管癌の腫瘍径別の生存期間を追跡した国内の調査では、腫瘍径の増大に伴ってOS中央値は段階的に短縮し、2cm以下の94.49ヵ月に対して5~10cmでは32.00ヵ月、10cm超では19.78ヵ月でした2)。腫瘍の個数に関しても同様で、OS中央値は1個で65.48ヵ月、2個では44.98ヵ月、3個以上は大幅に短縮して16.95ヵ月です2)。日本における肝内胆管癌患者の臨床病期はステージⅣが50.5%と最も多いので、約半数が切除不能な進行癌として発見されていることになります3)。
肝内胆管癌の危険因子
工藤 危険因子についてはいかがでしょうか。
黒崎 肝内胆管癌では、肝硬変が最もリスクの高い背景病変です。その他、ウイルス性肝炎、B型肝炎、C型肝炎、飲酒、糖尿病、肥満、喫煙、非アルコール性脂肪肝炎、肝吸虫、原発性硬化性胆管炎、肝内結石症、胆道拡張症、カロリー病と炎症性腸疾患などが指摘されています(図2)。
小無田 危険因子は、肝内胆管癌の亜型(大型胆管型・小型胆管型)に関連することが知られています。例えば、ウイルス性肝炎や脂肪性肝炎のような肝細胞を障害する因子は小型胆管型、肝吸虫症や原発性硬化性胆管炎など大型胆管の持続的炎症を誘発する因子は大型胆管型に関連する、という感じです。
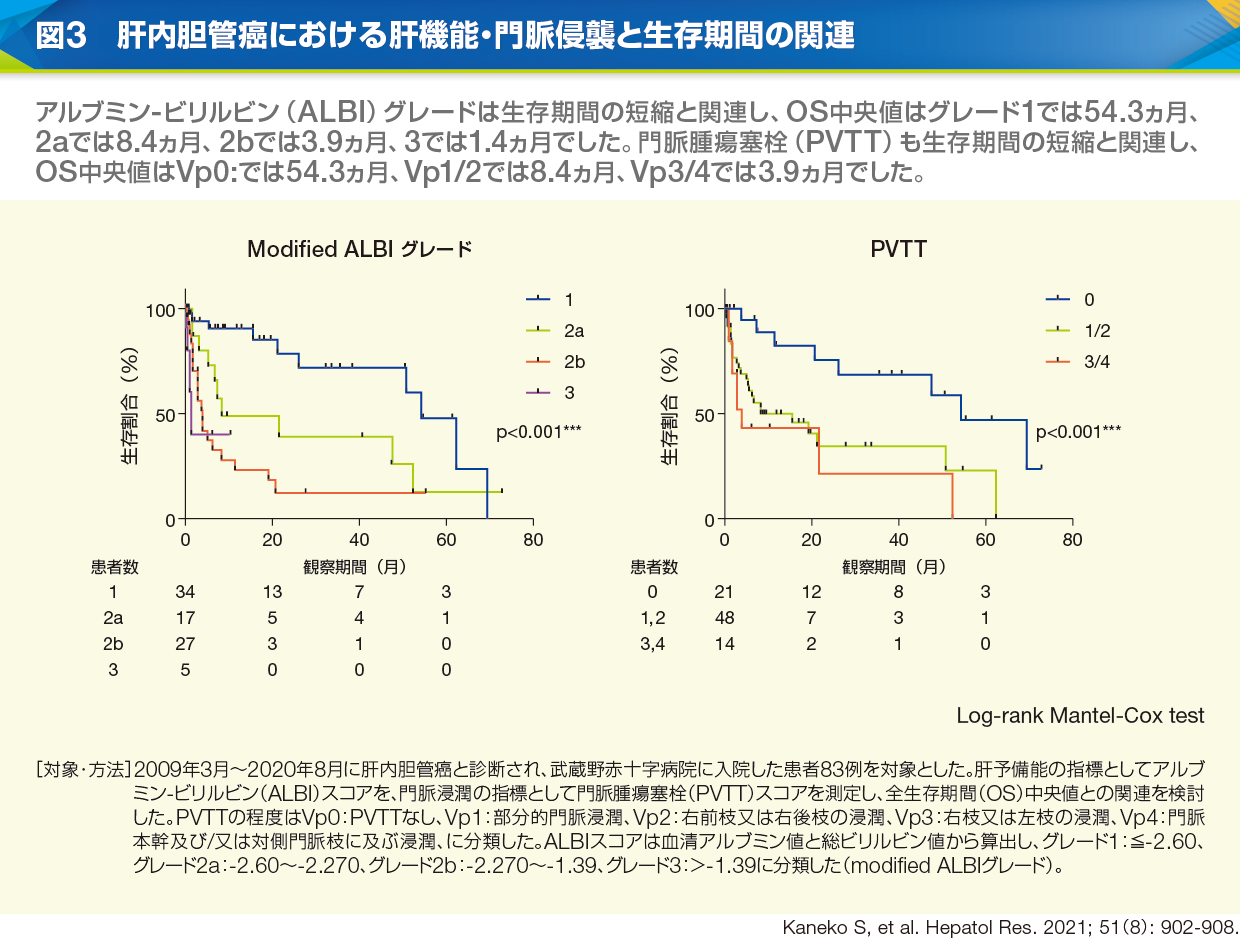
黒崎 自験例ですが、肝予備能の指標であるアルブミン-ビリルビン(ALBI)グレードと門脈浸潤の程度が予後と密接に関連することが分かりました。肝内胆管癌患者83例中、慢性肝疾患を有する例は半分以下でしたが、ALBIグレード別にOS中央値をみると、患者全体でグレード1では54.3ヵ月、2aでは8.4ヵ月、2bでは3.9ヵ月、3では1.4ヵ月と、ALBIグレード1の群と2以上の群では大きな乖離がありました(図3)。門脈浸潤の程度についても、門脈浸潤のないVp0の群に比べて門脈浸潤のある群ではOSが顕著に短縮していますが(図3)、腫瘍径、CA19-9値、リンパ節転移も加えた背景因子の中で、多変量解析において予後と関連が認められたのはALBIグレードだけでした4)。

ディスカッションポイントのアンサー
Q1:画像検査の非典型例には生検が推奨されるか?
⇒A1:画像所見が非典型的で腫瘍マーカーの測定結果によっても鑑別診断できない場合や、薬物治療が想定される切除不能例では生検による確定診断を考慮する。
Q2:肝内胆管癌の臨床病理学的特徴は?
⇒A2:肝内胆管癌は大型胆管型と小型胆管型に分類され、これらは肉眼的/組織学的特徴、悪性度、検出されるアクショナブル遺伝子が異なる。
Q3:病理検査による鑑別診断において重要なポイントは何か?
⇒A3:適切な治療レジメンの選択のためにも正確な組織診断が不可欠であり、すべての原発性肝癌についての知識と経験に基づいて鑑別診断を行う必要がある。
画像検査における鑑別診断のポイント
工藤 肝内胆管癌の診断では肝細胞癌との鑑別が特に重要です。画像検査による鑑別のポイントをお教えください。
黒崎 肝細胞癌の典型例では、造影MRIでは早期の増強効果と後期相のwashoutが認められます(図4)。一方、末梢型肝内胆管癌に多い腫瘤形成(MF)型の典型例は、単純CTでは低吸収を示し、造影検査では早期にリング状の濃染が認められ、約7割の例では後期相に遷延性濃染が特徴的に認められます5)。慢性肝疾患の背景がある多血傾向の腫瘍は肝細胞癌と診断しがちですが、肝内胆管癌患者の増加を踏まえると、血流動態が非典型的な結節は生検による診断も重要な選択肢ではないでしょうか。
小無田 実際、欧米の主な学会のガイドラインをみてみると、米国のNCCN以外は生検を推奨または状況に応じて個別に判断としています6)。肝細胞癌でも、硬化型肝細胞癌のように線維化の強い腫瘍ではwashoutが遅延する可能性もありますし、逆に肝細胞癌でも非典型的な画像所見を呈する場合もあります7)。以上から、特に薬物治療が想定される場合には、組織検査と併せた包括的診断が望ましいのではないか、と思われます。
工藤 鑑別目的で行う生検の有用性については議論のあるところですが、画像検査の非典型例において、AFP、PIVKA-IIなどの肝細胞癌の腫瘍マーカーが上昇していない場合、切除可能例では肝内胆管癌を想定した上で切除、切除不能例では生検を考慮するということでよろしいでしょうか。次に、病理診断における鑑別のポイントについてお願いします。

肝内胆管癌の臨床病理学的特徴
小無田 肝内胆管癌は、粘液産生を特徴とする悪性度の高い大型胆管型と、組織多彩性を特徴とする小型胆管型に二分されます。肉眼像では、小型胆管型は、全例が腫瘤を形成(MF型)するのに対し、大型胆管型は胆管壁に沿って拡がる胆管浸潤(PI)型ないし胆管浸潤型が肝実質に浸潤し腫瘍を形成するPI+MF型を呈します。ドライバー遺伝子としては、大型胆管型では肝内・肝外胆管癌でも検出されるKRASやSMAD4などの変異が検出され、小型胆管型ではアクショナブル遺伝子であるFGFR2融合遺伝子やIDH1/IDH2変異が特徴的に認められます8)。以上から、適切な治療レジメンの選択のためにも、亜型分類を含めた腫瘍診断が必要となります。
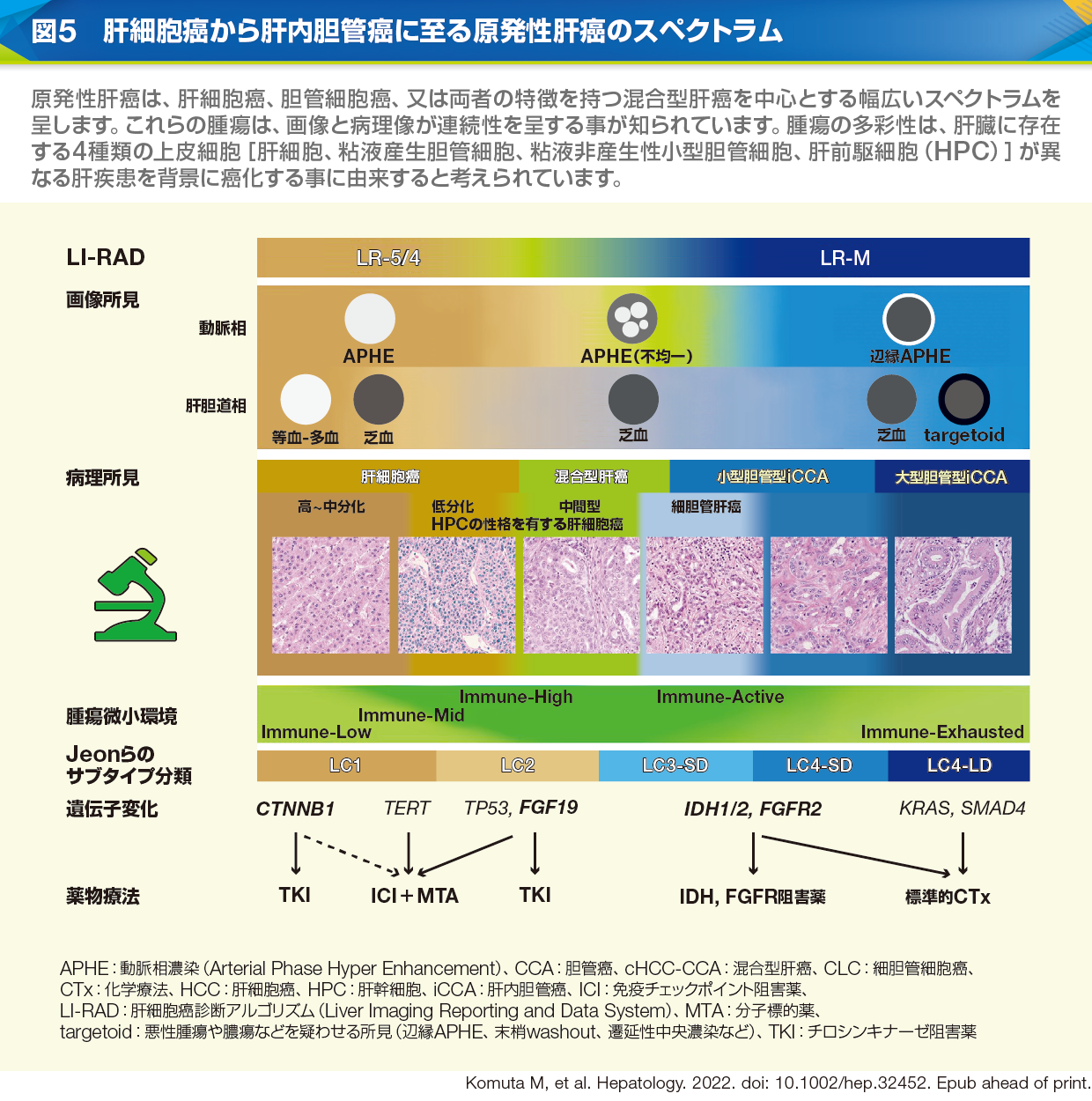
肝細胞癌から胆管癌に至る病理学的・分子生物学的スペクトラム
小無田 原発性肝癌は、肝細胞癌、肝内胆管癌、混合型肝癌から主に構成され、スペクトラムを形成しています(図5)。スペクトラムの対極には、高~中分化の肝細胞癌と大型胆管型肝内胆管癌、そして中央には両者の成分を有する混合型肝癌が位置します。それらの腫瘍間には、細胆管癌や小型胆管型肝内胆管癌、肝前駆細胞の性格を有する肝細胞癌などが認められます。これらの腫瘍は、その組織多様性により画像所見も重複することから、鑑別診断が困難である場合が少なくありません。以上から、肝内胆管癌の診断精度向上のためには、胆管癌だけでなく肝細胞癌も含めたすべての原発性肝癌の認識が重要となり、確定診断には臨床・画像所見および病理所見を併せた総合的な判断が必要になると考えられます(図4)。
ディスカッションポイントのアンサー
Q1:肝内胆管癌診療においてがん遺伝子パネル検査に基づくがんゲノム医療は有用か?
⇒A1:肝内胆管癌ではがんゲノム医療の有益性が比較的高い。
Q2:がん遺伝子パネル検査を想定した検体採取のタイミングは?
⇒A2:検査に要する時間を考慮し、標準治療終了前の検体採取が推奨される。
Q3:肝内胆管癌のがん遺伝子パネル検査における注意点は?
⇒A3:検体採取時には腫瘍細胞を多く含む部位を選び、過固定を避ける。
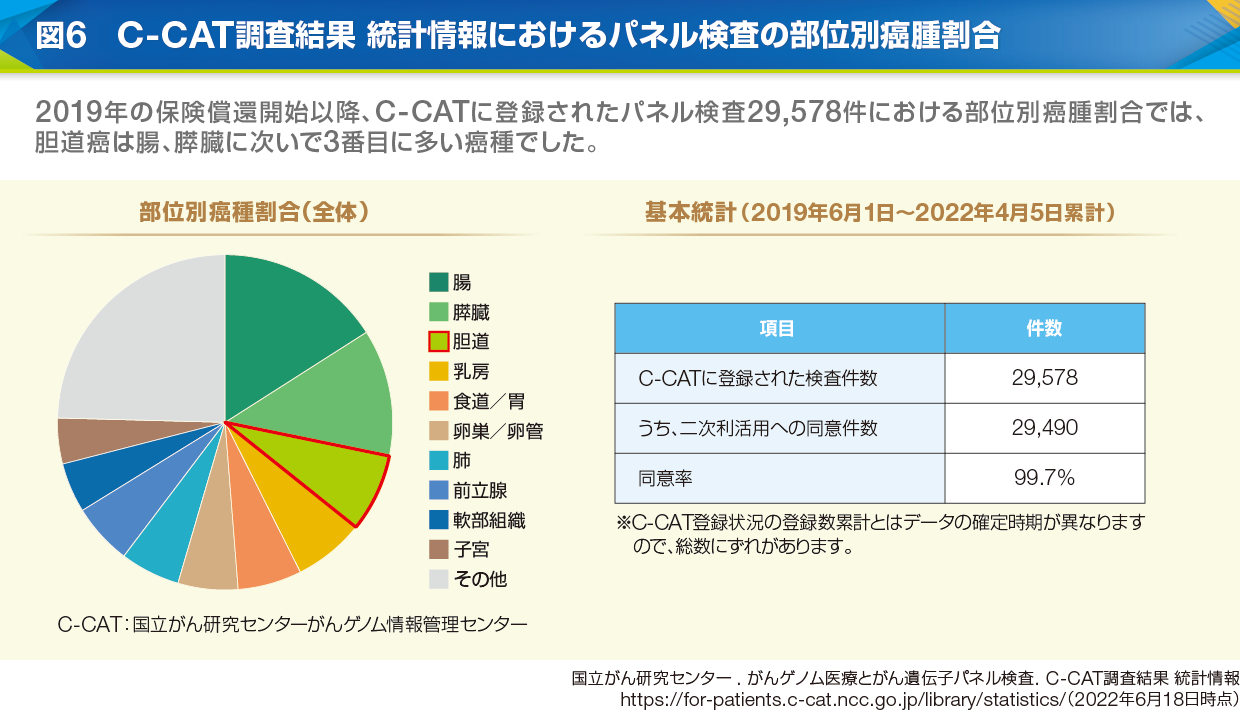
工藤 2019年よりがん遺伝子パネル検査(パネル検査)が保険償還開始となりましたが、肝内胆管癌における実施状況はいかがでしょうか。
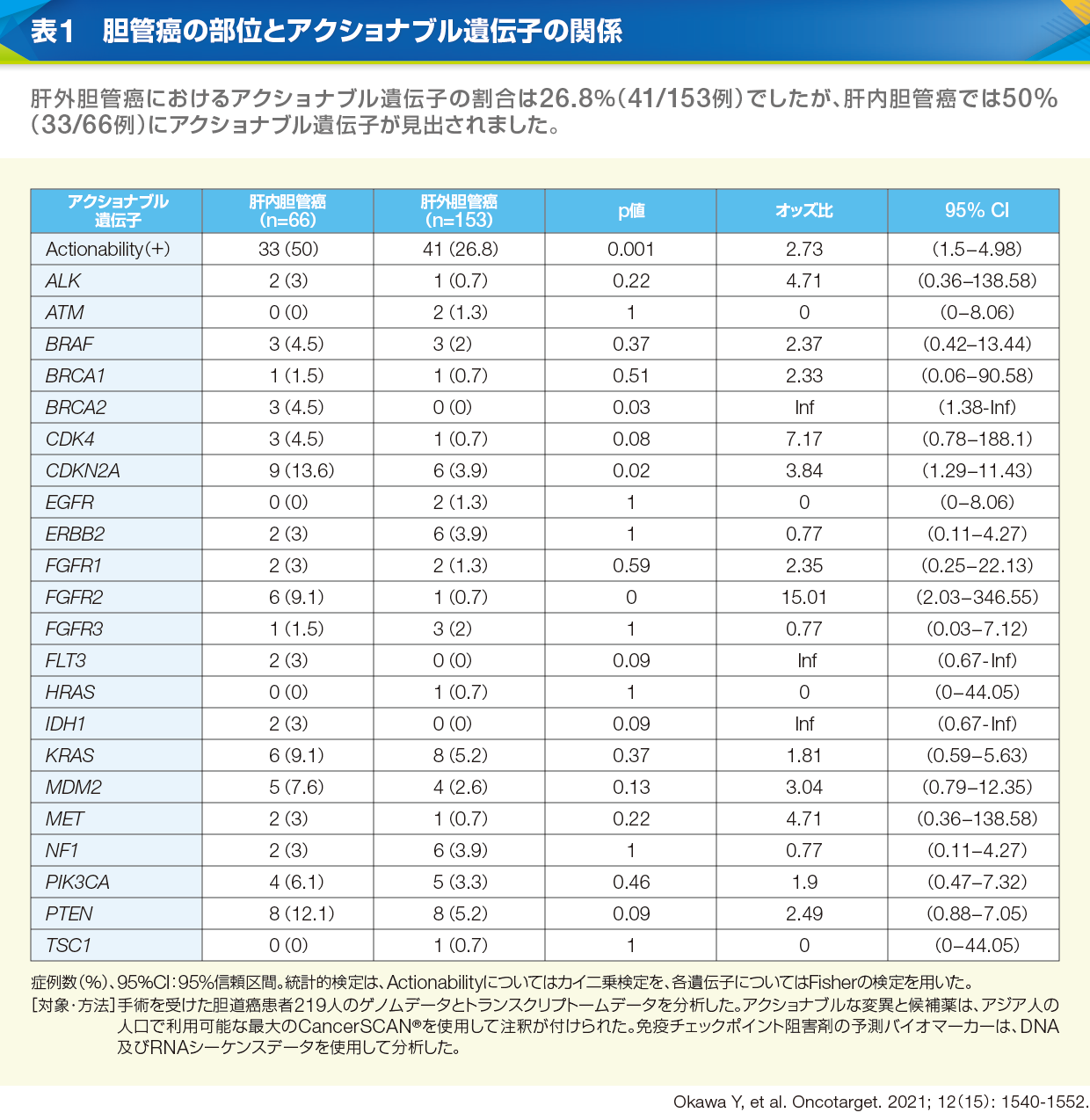
長谷川 2022年4月までの累計では、パネル検査に胆道癌の占める割合は第3位でした(図6)。肝内胆管癌では50%にアクショナブル遺伝子が見出されていますので(表1)、がんゲノム医療の有益性は比較的高いと思います。一方、検体の提出から患者説明までに2~3週間以上を要しますから、早めの検体提出が必要です。現在は、持ち回り協議で出席者の見解が一致する場合はリアルタイムの協議によるエキスパートパネルは不要になり、期間が少し短縮されました(図7)。
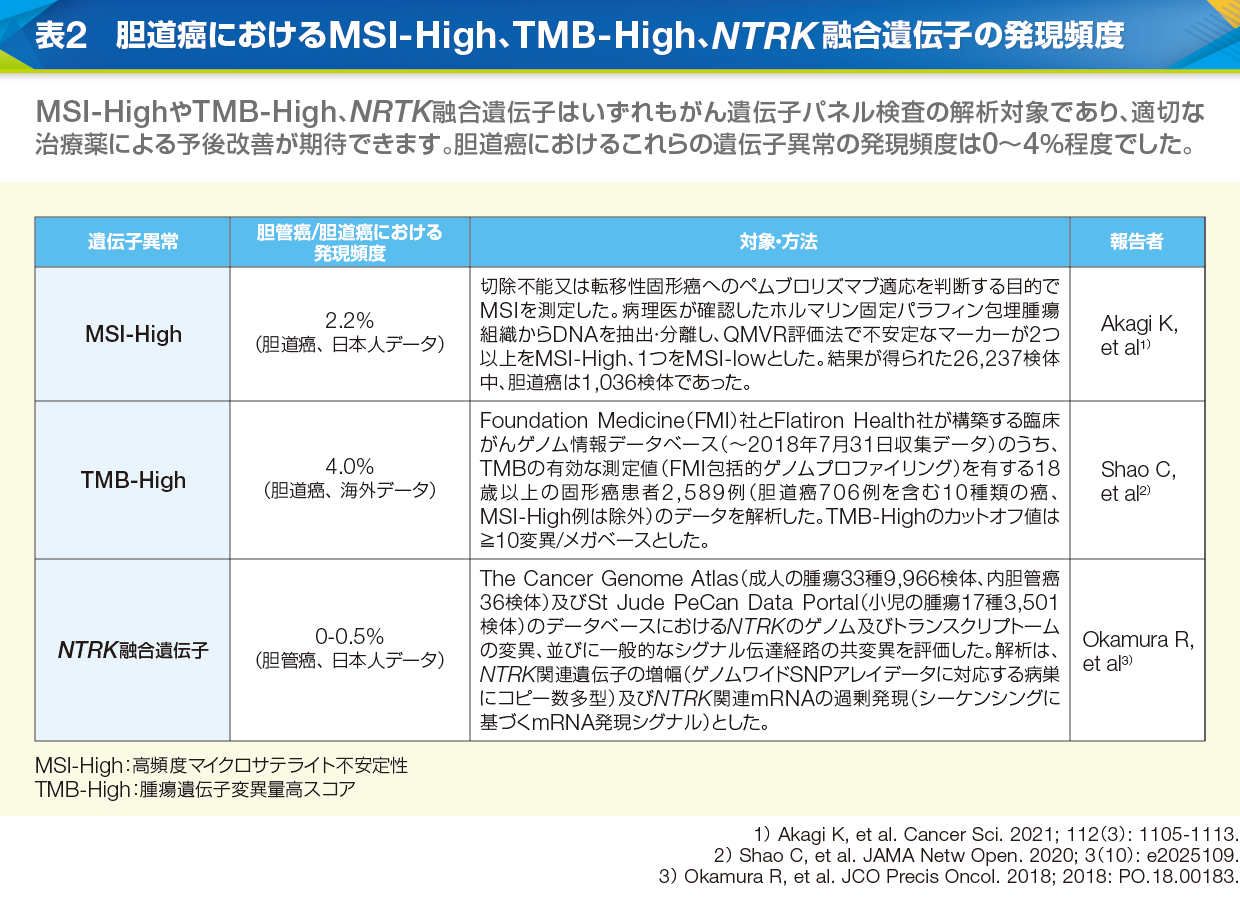
黒崎 肝内胆管癌におけるFGFR2融合遺伝子の発現頻度は日本人では5.3~13.6%と報告されており9、10、11)、MSI-HighやTMB-High、NRTK融合遺伝子も胆道癌では0~4%程度認められています(表2)。これらの遺伝子異常に対しては有効な治療薬が承認されていますが、その他のアクショナブル遺伝子に対しては、自費診療、臨床試験への参加、先進医療B制度や患者申出療養制度の利用などを検討することになります。
工藤 検体採取における適切な時期と注意点についてはいかがでしょうか。
小無田 現時点では、検体採取の適切な時期についてのコンセンサスはありませんが、検体採取から結果説明までの時間を考慮すると、胆道癌の鑑別診断時や一次治療施行前、手術による臓器摘出時の検体採取が望ましいと考えます。検体採取の際には、放射線科医と連携して腫瘍細胞がより多く採取できる部位を選ぶこと、ホルマリンによる過固定を避けることが大切です。リキッドバイオプシーについては、FGFR2融合遺伝子の検出率が組織検体よりも低いとの報告もあるため12)、その有用性については更なる検討が必要だと思います。

ディスカッションポイントのアンサー
Q1:肝内胆管癌に有効な二次治療は確立されているか?
⇒A1:肝内胆管癌の二次治療の推奨は確立されていない。
Q2:切除不能肝内胆管癌におけるペミガチニブの適応と有効性は?
⇒A2:FGFR2遺伝子の融合/再構成が認められた治癒切除不能胆管癌において、ペミガチニブの有効性が検証されている。
Q3:ペミガチニブ投与において注意が必要な副作用はあるか?
⇒A3:ペミガチニブ投与では、網膜剥離および高リン血症に特に注意を要する。
工藤 切除不能肝内胆管癌では、ゲムシタビンベースレジメンが一次治療として強く推奨されていますが、二次治療についてはいかがでしょうか。
黒崎 二次治療についても様々なレジメンが検討されていますが、現在のところ奏効率は23%未満であり、無増悪生存期間(PFS)も最長で5.4ヵ月と13)、推奨の根拠となるエビデンスは不十分でした。しかし、2021年6月より、がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌に対して、FGFR阻害剤のペミガチニブ(ペマジール®錠)が使用可能になりました。
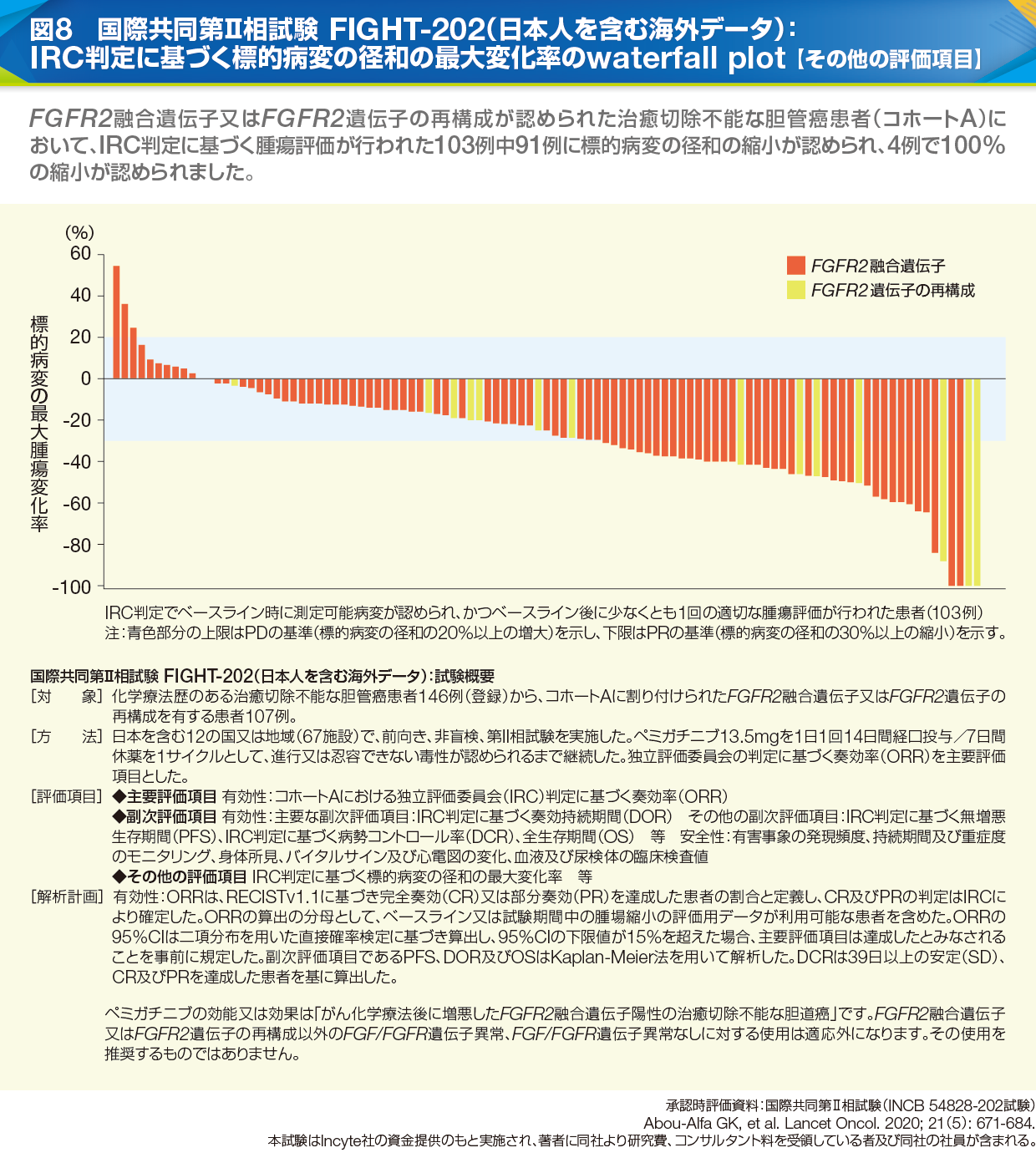
長谷川 国際共同第Ⅱ相試験FIGHT-202では、FGFR2融合遺伝子またはFGFR2遺伝子の再構成が認められた治癒切除不能な胆管癌患者107例(コホートA)において、独立評価委員会判定に基づいて、奏効率35.5%(95%CI:26.50~45.35)、PFS中央値6.93ヵ月(95%CI:6.18~9.59)、OS中央値21.06ヵ月(95%CI:14.82~評価不能)が達成され、103例中91例で標的病変の径和が縮小しました(図8)。
黒崎 安全性については、コホートAの107例において、副作用が94.4%、重篤な副作用が3.7%認められました(図9)。重大な副作用として網膜剥離(1.9%)および高リン血症(53.3%)が報告されており、投与期間中も副作用の発現状況を十分観察する必要があります。

黒崎 画像検査の進歩によって非典型的な肝腫瘍として描出される例も増えていますので、消化器内科医としては肝内胆管癌の可能性も踏まえた慎重な診断が大事だと思います。肝腫瘍生検をどのような症例に施行するべきかについてコンセンサスは確立していませんが、非典型的な肝腫瘍における鑑別目的の生検には意義があると考えます。少なくとも肝内胆管癌疑いの症例では、ゲノム診断も想定して適切な治療を選択できるよう、早期の生検による確実な診断を考慮したいと思います。このような情報を広く提供することも、我々の役割だと感じています。
長谷川 消化器外科医の立場からは、切除可能例では切除を実施し、術後再発した場合の治療戦略に手術検体を活用するという流れの普及を期待しています。生検に伴う播種の影響については今後の評価が必要ですが、播種の影響を避ける意味でも、切除可能例では手術検体で診断することが望ましいと思います。適切な分子標的療法の選択により、切除不能例から切除可能例へのconversion例が増加する可能性にも期待しています。
小無田 肝内胆管癌は治療のターニングポイントを迎えていると思います。病理医は、腫瘍生検検体や手術検体を適切に診断して治療につなげることがより重要となります。そのため診断に苦慮する場合に専門医にコンサルトできるようなシステムを確立していく必要があると思います。肝内胆管癌の中でも大型胆管型は悪性度が特に高いことから、完全治癒には外科切除が有効だと考えられます。今後は薬物療法後に手術適応となる症例が増えることを期待しています。
参考文献
1)Waseem D, et al. Ann Hepatol. 2017; 16(1): 133-139.2)日本肝癌研究会肝癌追跡調査委員会:第23回全国原発性肝癌追跡調査報告、20213)国立がん研究センター・がん対策情報センター「がん診療連携拠点病院等 院内がん登録」2020年全国集計報告書(都道府県推薦病院、小児がん拠点病院、任意参加病院を含む)https://ganjoho.jp/public/qa_links/report/hosp_c/pdf/2020_report.pdf(2022年6月18日アクセス)4)Kaneko S, et al. Hepatol Res. 2021; 51(8): 902-908.5)日本肝癌研究会 編. 肝内胆管癌診療ガイドライン(2021年版). 金原出版. 20206)Fong ZV, et al. Ann Surg Oncol. 2021; 28(5): 2660-2674.7)Rhee H, et al. Liver Cancer. 2019; 8(1): 24-40.8)Hayashi A, et al. Am J Surg Pathol. 2016; 40(8): 1021-1030.9)Arai Y, et al. Hepatology. 2014; 59(4): 1427-1434.10)Maruki Y, et al. J Gastroenterol. 2021; 56(3): 250-260.11)Tsujie M, et al. Jpn J Clin Oncol. 2021; 51(6): 911-917.12)Israel MA, et al. Oncologist. 2021; 26(9): 787-796.13)日本肝胆膵外科学会 胆道癌診療ガイドライン作成委員会 編. エビデンスに基づいた胆道癌診療ガイドライン 改訂第3版. 医学図書出版. 2020

ページ右下のチャットよりお問い合わせください。
受付時間:9:00~17:30
(土・日・祝祭日及び当社休日を除く)
これより外部のWebサイトに
移動します。
よろしければ下記URLを
クリックしてください。